技術の背景
核酸医薬
低分子医薬、抗体医薬に続く、新しい医薬品モダリティーとしての核酸医薬の実用化が実現してきました。これまで治療薬のなかった遺伝病に対する画期的な治療薬として、多くの患者および家族の希望となっています。さらに、多くの疾患の治療薬の開発が望まれています。
体内動態および体内分布の把握技術の重要性
核酸医薬の治療効果を高めるため、全身投与量を増加させると、治療目的の臓器以外にも高濃度の核酸医薬が分布し、副作用の原因となります。従って、核酸医薬が目的臓器に到達した体内分布を把握しながら投与する必要があります。さらに分布した核酸医薬の目的臓器に分布する持続時間を把握することも重要です。
合成済みの核酸医薬を、簡便かつ低コストでトリチウムラベル化する技術
ラジオアイソトープで標識された医薬品は体外から医薬品の分布を把握するために広く用いられていますが、核酸医薬では、ラジオアイソトープでの標識化の困難さから、その利点が十分に活用されていない状況です。RINAT Imaging社では、核酸の所望の位置を選択的に化学修飾できる画期的な技術を確立しました。この技術によって、すでに合成された核酸医薬を簡便に低コストでトリチウムラベル化することが可能です。
動物実験による体内動態研究から、核酸医薬の候補化合物の絞り込み
核酸医薬は、効果の増強と副作用の低減のため、体内動態の制御が大切です。トリチウムラベル化核酸医薬を用いることで、動物における体内動態研究が容易になることで、候補化合物の絞り込みに役立ちます。
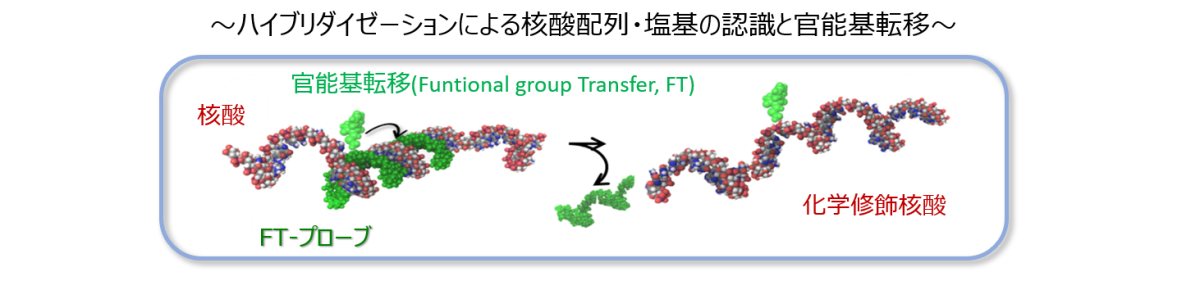
技術の概要
反応スキーム
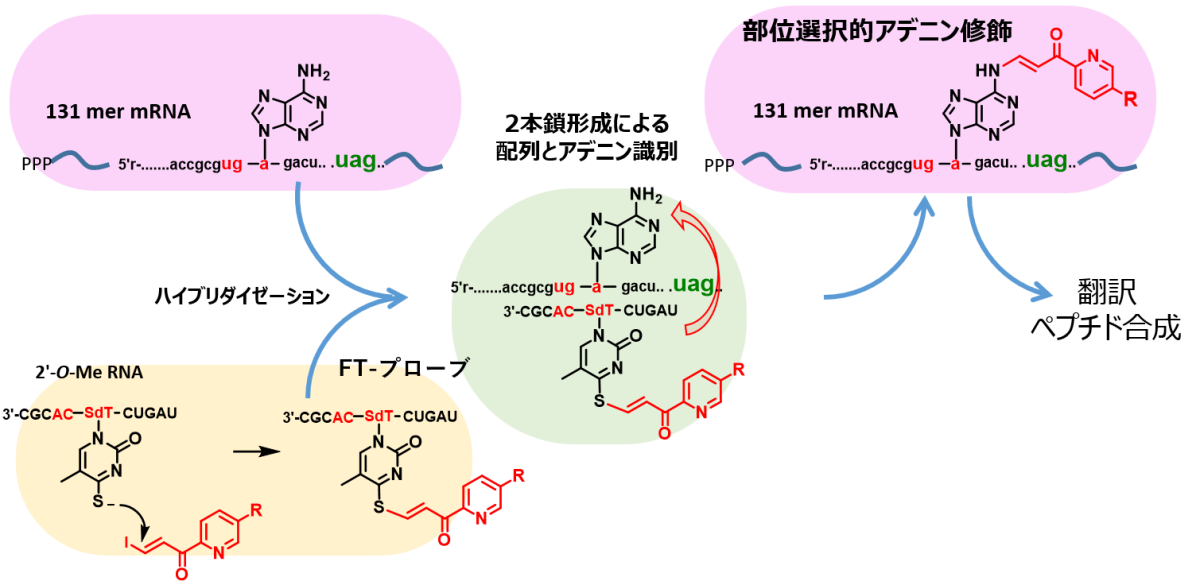
官能基を持つプローブ核酸は、官能基転移(functional group transfer) の略で「FT-プローブ」と呼びます。本技術はつぎのスキームで核酸を標識化します。(参考文献1〜3)
- 1)標的核酸に相補的な配列のFT-プローブを設計・合成する。
- 2)標的核酸とFT-プローブを混合し、二本鎖を形成させ、化学修飾核酸を合成する。
- 3)化学修飾核酸をNaBT4で還元し、トリチウムラベル化核酸を合成する。
ラジオアイソトープ標識によって可能になる核酸医薬動態解析
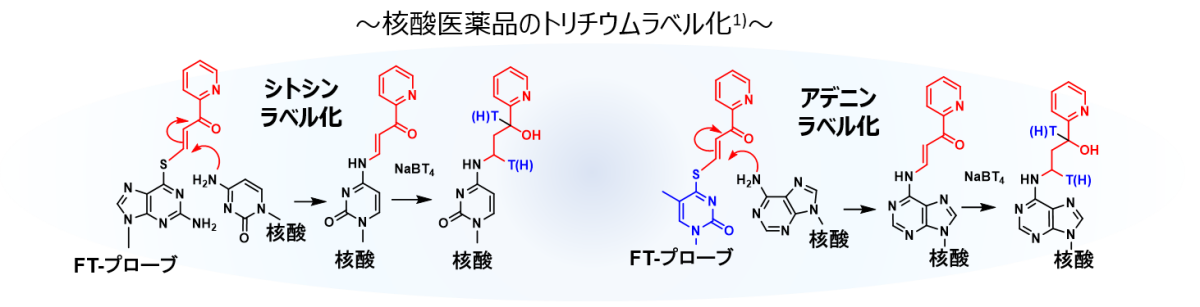
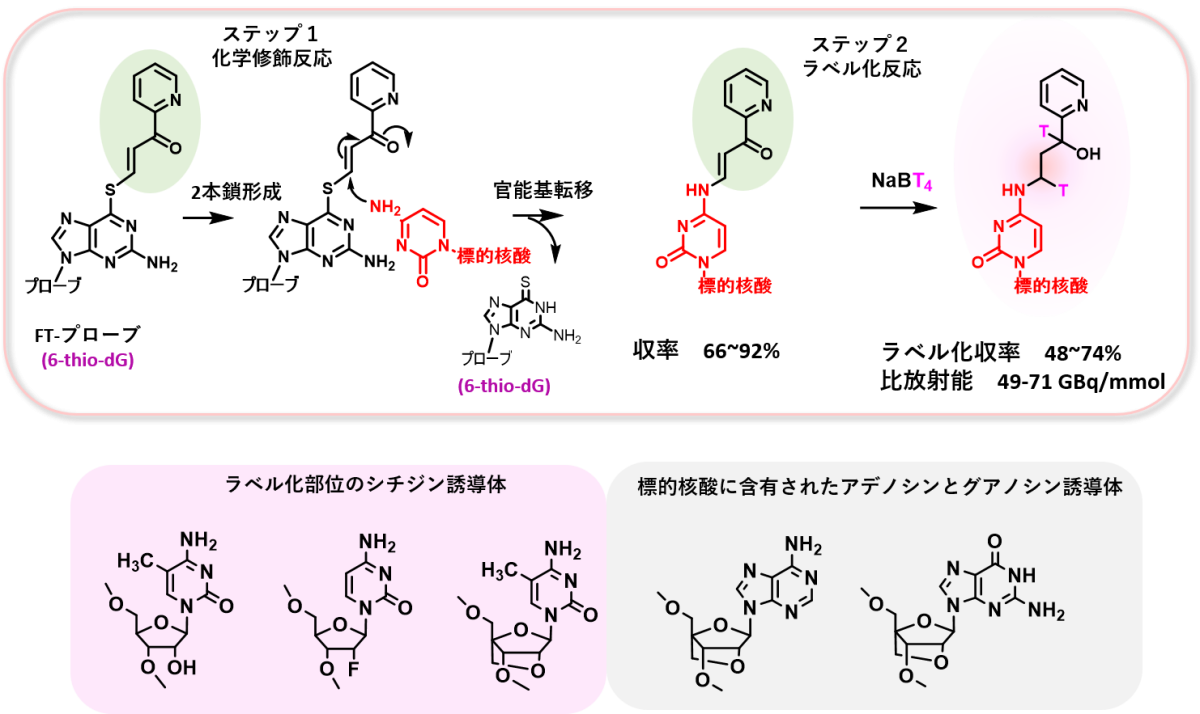
実施例1 シチジン部位のトリチウムラベル化(参考文献4)
2’-デオキシー6-チオグアノシンに官能基を持つFT-プローブを用いて、種々の修飾糖部分をもつオリゴ核酸シチジン部分の効率的なトリチウム化を実現しました。
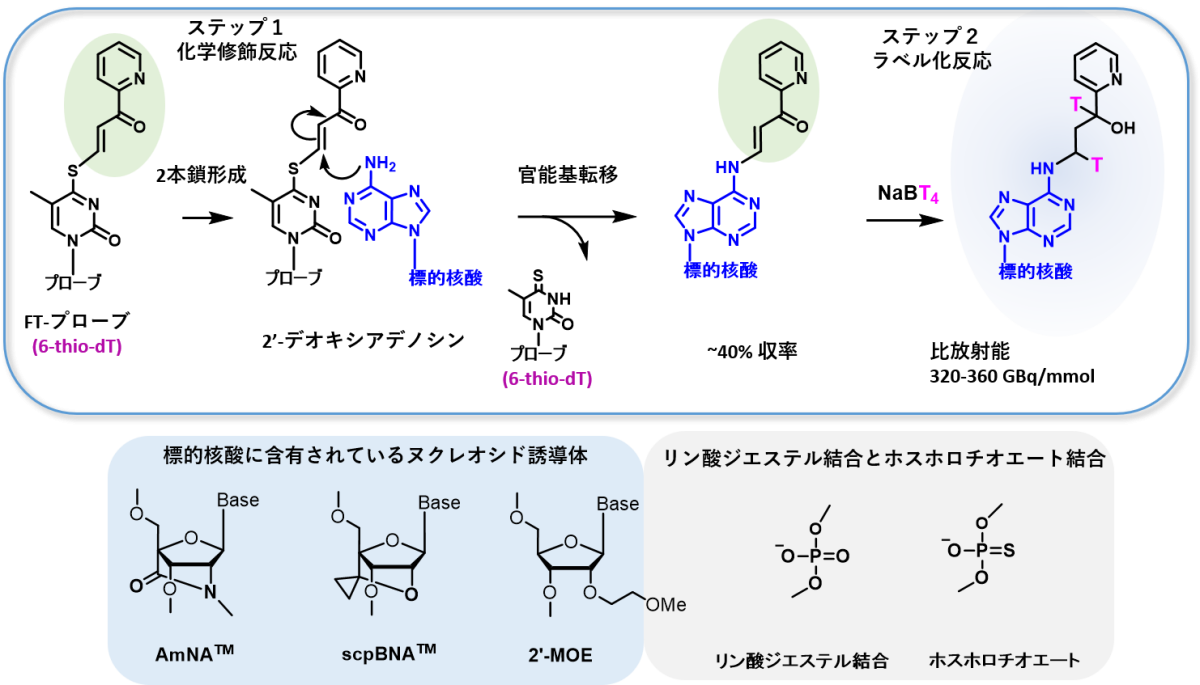
実施例2 アデノシン部位のトリチウムラベル化 (参考文献5) (Luxna Biotech株式社および積水メディカル株式会社との共同研究)
4-チオチミジンに官能基を持つFT-プローブを用いて、種々の修飾糖部分をもつオリゴ核酸アデノシン部分の効率的なトリチウム化を実現しました。
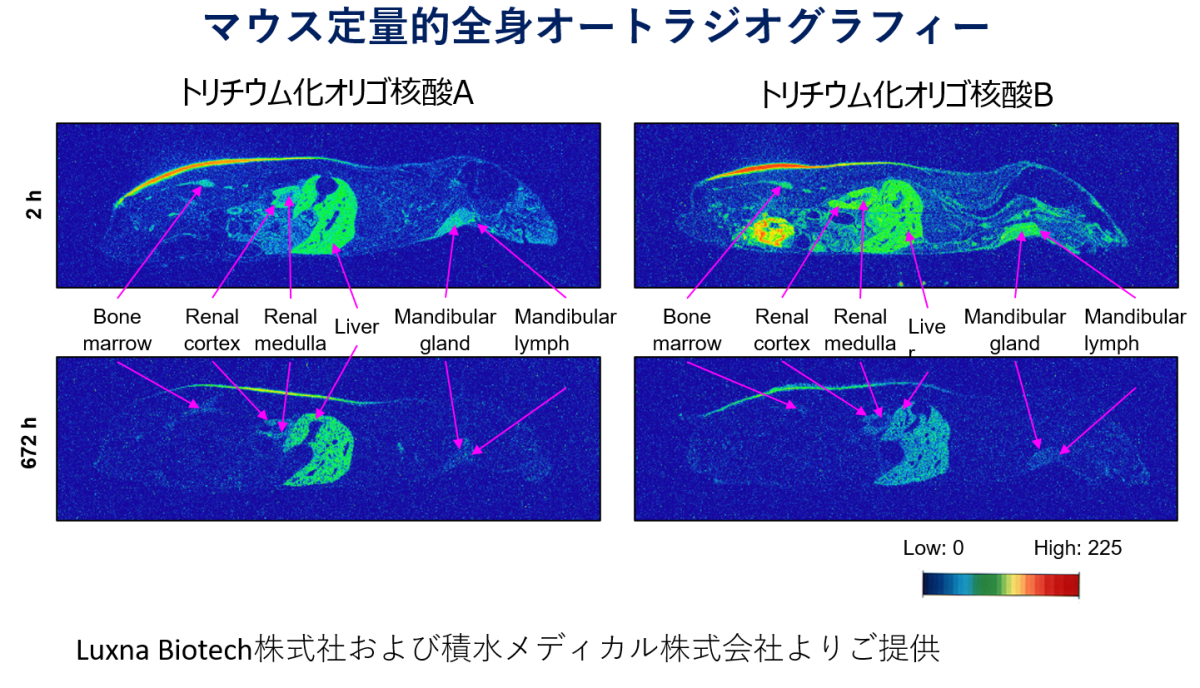
実施例3 トリチウムラベル化オリゴ核酸のマウス体内動態 (参考文献5) ( Luxna Biotech株式社および積水メディカル株式会社との共同研究)
アデノシンをトリチウム化したオリゴ核酸(2種類)のマウスに投与し、定量的全身オートラジオグラフィー測定を行いました。マウス体内分布は、一般的なアンチセンス核酸と同様に分布を確認しました。
実施例4 mRNAアデノシンの化学修飾(参考文献6)
4-チオチミジンに官能基を持つFT-プローブを用いて、131ヌクレオチドを含むmRNA中の未熟停止コドン(PTC)の3番目アデノシンの選択的な化学修飾を実現しました。この化学修飾によって大腸菌翻訳系では、未熟停止コドン部分(PTC)にアミノ酸が挿入され、正常停止コドンまで全長のペプチドが産生することを発見しました(参考文献6)。
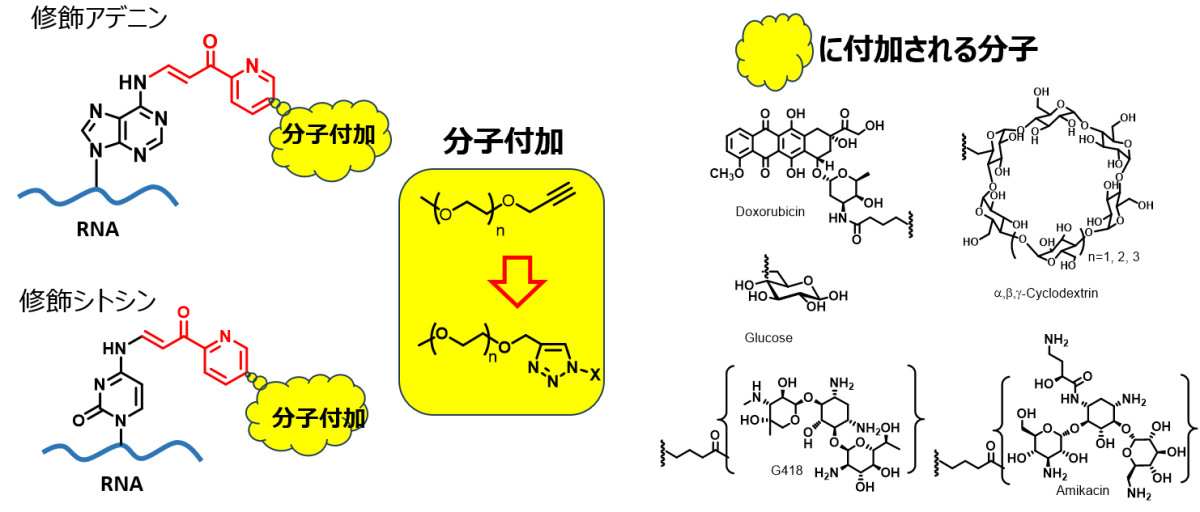
技術の展開:核酸の配列内部への蛍光物質やラジオアイソトープの導入
核酸の内部位置に導入された分子に、さらに蛍光分子や複雑な天然物を導入することが可能です(参考文献6)。この技術を活用し、ヨウ素131やフッ素18でラベル化した分子を導入することで、核酸の生きた生体内での分布をイメージングする技術に展開できると期待されます。
技術の特徴および注意点
- 1)8位トリチウム化プリン塩基や5位トリチル化ウラシル塩基と異なり、T→H交換は少ない。
- 2)合成済みの核酸医薬品をラベル化できる。
- 3)長鎖RNAをラベル化できる。
【比較】5’-T、14C-ラベル化体は、対応する前駆体を固相合成装置でオリゴ核酸に組み入れる。
【注意点】トリチウムラベル体は核酸医薬品の構造修飾体となる。
参考文献
- (1)Development of Novel Functional Molecules Targeting DNA and RNA. Shigeki Sasaki, Chem. Pharm. Bull. 67, 508-518 (2019). doi.org/10.1248/cpb.c19-00169.
- (2)Site-specific modification of the 6-amino group of adenosine in RNA by an inter-strand functionality-transfer reaction using an S-functionalized-4-thiothymidine, Oshiro I., Jitsuzaki D., Onizuka K., Nishimoto A., Taniguchi Y., and Sasaki S., ChemBioChem, 16, 1199-1204 (2015). doi.org/10.1002/cbic.201500084.
- (3)Remarkable acceleration of a DNA/RNA inter-strand functionality transfer reaction to modify a cytosine residue: the proximity effect via complexation with a metal cation, Jitsuzaki D., Onizuka K., Nishimoto A., Oshiro I., Taniguchi Y., Sasaki S., Nucleic Acids Research, 42, 8808–8815 (2014). doi.org/10.1093/nar/gku538.
- (4)Site-Specific Tritium Labeling at the Predefined Internal Position of the Chemically-Modified RNA, Murase H., Lee J., Taniguchi Y., Sasaki S., Chem. Pharm. Bull. 71, 64-69 (2023). doi.org/10.1248/cpb.c22-00738.
- (5)The site-selective tritium labeling of antisense nucleic acids using functionality transfer reaction for pharmacokinetic studies, Ishikawa K., Takahashi N., Kikuchi T., Ito S. Sasaki S., Kumagaya S., Chiba K., Sonoda K., Kenta Hashizume K. , 日本核酸医薬学会第9回年会、2024年7月15-18日(仙台).
- (6)The selective chemical modification of the 6-amino group of adenosine of the premature termination codon induces readthrough to produce full-length peptide in the reconstituted E. Coli translation system, Murase H., Lee J., Togo N., Taniguchi Y. Sasaki S., Bioorganic & Medicinal Chemistry, 111, 117868 (2024), 10.1016/j.bmc.2024.117868.